(10分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_________________________ 。(2分)
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式______________________。(2分)
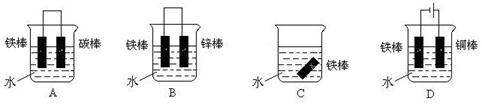
(3)下列哪些装置可防止铁棒被腐蚀_____________ 。(1分)
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:

请回答:
① A电极对应的金属是 (写元素名称),(1分)B电极的电极反应式是 。(2分)
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因: 。(2分)
(1)Fe2O3 + 3CO  2Fe + 3CO2 (2)FeCl3 + Fe = 3FeCl2 (3)BD
2Fe + 3CO2 (2)FeCl3 + Fe = 3FeCl2 (3)BD
(4)①铜(写元素名称),Cu2+ + 2e- = Cu
②铁比铜活泼,镀层铜被破坏后形成的原电池铁做负极,腐蚀加快,而镀锌刚好相反
铁锈的主要成份为:Fe2O3 ·2H2O;
(2)加入盐酸:Fe2O3 +6HCl="2" FeCl3 +3H2O ;
当铁锈被除尽后,即可发生如下反应:2FeCl3+Fe = 3FeCl2
(3)金属的防腐一般可通过牺牲阳极法、电镀法、电解池作阴极法。
(4)电镀时镀件为阴极、镀层金属为阳极。
