(16分)如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题:
(1)打开K2,闭合K1,B为__________极,A的电极反应为______________,最终可观察到的现象是 。
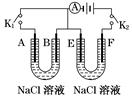
(2)打开K1,闭合K2,E为________极,检验F极产生气体的方法是 。
(3)若往U型管中滴加酚酞,进行(1)、(2)操作时, 极周围能变红(填A、B、E、或F,下同)。若滴加K3[Fe(CN)6]溶液,在 极周围溶液变为 色。
(4)若电源选用燃料电池,结构如图,以熔融碳酸盐为电解质(能够传导CO32-),电池工作时电解质组成保持稳定,请写出正极反应的方程式 ,若在标况下消耗11.2L的甲烷,电解NaCl溶液产生的H2的物质的量为 mol(假设燃料电池能量转化率为75%)。
xk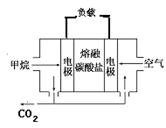
(1)负;(1分)O2+2H2O+4e-===4OH-;(2分)溶液中有红褐色沉淀生成(2分)(2)阴;(1分)用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气(2分)(3)A、E;(2分)B;(1分)蓝(1分)(4)2CO2+O2+4e-=2CO32-(2分);1.5(2分)
(1)打开K2,闭合K1后,构成原电池,B是铁片,作负极,A是正极,由于溶液是氯化钠溶液,因此相当于铁的吸氧腐蚀,正极反应式为O2+2H2O+4e-===4OH-。铁失去电子生成亚铁离子,然后结合OH-生成Fe(OH)2沉淀,最终被氧化生成氢氧化铁沉淀。
(2))打开K1,闭合K2,装置是电解池F是阳极,E是阴极,阳极氯离子放电,生成氯气,可利用氯气的氧化性来检验。
(3)在(1)中A是正极,有OH-生成,在(2)中阴极有OH-生成,即这两极溶液显红色。因为B极附近生成铁离子,所以溶液会变成蓝色。而在操作(2)铁作阴极不溶解,过不可能变蓝色。
(4)正极氧气得到电子,而电解质是熔融碳酸盐,导电离子是CO32-,所以正极反应的方程式为2CO2+O2+4e-=2CO32-。在反应中甲烷失去8个电子,因为电池能量转化率为75%,所以11.2L的甲烷实际失去电子为4mol×0.75=3.0mol,依据电子得失守恒可知生成氢气1.5mol。
