某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图:
(1)写出甲中通入甲醇这一极的电极反应式 。
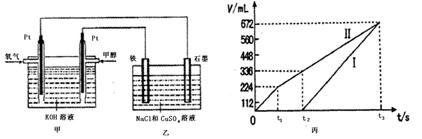
(2)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ,原混合溶液中NaCl的物质的量浓度为 mol/L,CuSO4的物质的量浓度为 mol/L。(假设溶液体积不变)
(3)电解至t3时,消耗水的质量为 g。
(1)CH3OH-6e-+8OH-=CO32-+6H2O(2分)
(2)4OH--4e-=O2↑+2H2O (2分) 0.1(2分) 0.1(2分)
(3)0.72 (2分)
(1)甲图为甲醇燃料电池, 2CH3OH+3O2=2CO2+4H2O ①
CO2+2KOH=K2CO3+H2O ②
①+②×2,得:甲醇燃料电池的总化学反应为:2CH3OH+3O2+4KOH=6H2O+2K2CO3
总离子反应为:2CH3OH+3O2+4OH-=6H2O+2CO32-
(+):O2+2H2O+4e-=4OH-
(-)=总离子反应-(+)×3,得:2CH3OH+16OH--12e-=12H2O+2CO32-
化简,得:CH3OH - 6e-+ 8OH- = CO32-+ 6H2O
(2)乙图为电解池,铁片接甲图的负极,故铁片做电解池的阴极;
石墨棒接甲图的正极,故石墨棒做电解池的阳极;
溶液中阴离子(Cl-、OH-、SO42-)移向阳极,且放电顺序为:Cl->OH->SO42-,
电极反应为:先2Cl--2e-=Cl2↑,后4OH--4e-=O2↑+2H2O
阳离子(Cu2+、H+、Na+)移向阴极,且放电顺序为:Cu2+>H+>Na+,
电极反应为:先Cu2++2e-=Cu,后2H++2e-=H2↑
故丙图中,I线对应阴极(铁片)的反应,II线对应阳极(石墨棒)的反应;
分析丙图:到t1时,生成V(Cl2)=224ml,标准状况下n(Cl2)="0.01" mol,
2Cl--2e-=Cl2↑
2 1
n(Cl-) 0.01mol,则n(Cl-)= 0.02mol,C(NaCl)="0.02mol/0.2L=0.1" mol/L;
V(O2)="672ml-224ml=448" ml,标准状况下n(O2)="0.02" mol,故阳极失电子的物质的量为:
2Cl-- 2e- = Cl2↑ 4OH-- 4e- = O2↑+2H2O
2 1 4 1
0.02mol 0.01mol 0.08mol 0.02mol
两极电子转移守恒(均为0.02mol+ 0.08mol=0.1mol),则阴极得电子的物质的量为:
V(H2)="672ml," 标准状况下n(H2)=0.03mol,
2H++ 2e- = H2↑ 故 Cu2+ + 2e- =Cu
2 1 1 2
0.06mol 0.03mol 0.02mol 0.04mol
C(CuSO4)="0.02mol/0.2L=0.1" mol/L;
(3)2H2O=2H2↑+O2↑
36g 1mol
0.72g 0.02mol
