(4分)下图所示的三个实验中,实验1说明二氧化碳具有的性质是
;
实验2瓶中发生反应的化学方程式为 ;
实验3中观察到的现象是 ;
大理石与稀盐酸反应的化学方程式为 。
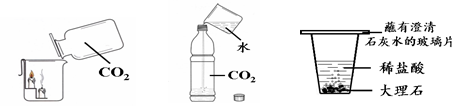
实验1 实验2 实验3
CO2的密度大于空气的密度,CO2不可燃,也不支持燃烧;
CO2 + H2O === H2CO3 ; 大理石表面有大量气泡冒出,大理石质量逐渐减少;
CaCO3 + 2HCl ===CaCl2 + CO2↑+ H2O
(1)实验1,把二氧化碳气体慢慢倒入放有燃着的蜡烛的烧杯中,下层蜡烛先灭,说明二氧化碳的密度比空气大、不燃烧和不支持燃烧的性质;
实验2,二氧化碳能与水反应生成碳酸,该反应的化学方程式为:H2CO3=H2O+CO2↑;
实验3,大理石能与稀盐酸反应生成二氧化碳,其反应方程式为:CaCO3+2HCl═CaCl2 +CO2↑+H2O,二氧化碳能与澄清的石灰水反应,使之变浑浊,故反应现象为:固体逐渐减少,有无色气泡产生,澄清石灰水变浑浊;
故答案为:(1)不燃烧也不支持燃烧,密度比空气大;CO2+H2O=H2CO3;固体逐渐减少,有无色气泡产生,澄清石灰水变浑浊;
CaCO3+2HCl═CaCl2 +CO2↑+H2O;
