问题
问答题
将一定量铜与足量浓硝酸充分反应,可以得到6.72L NO2气体(气体体积在标准状况下测定).
(1)写出铜与浓硝酸反应化学方程式.标明电子转移的方向和数目.
(2)若反应后溶液体积为100mL,则所得溶液中Cu2+的物质的量浓度是多少?
(3)若改用排水法收集气体,则可收集到气体的体积为多少?
答案
(1)铜与浓硝酸反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
答:
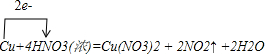
(2)根据得失电子守恒:n(Cu)×2=n(NO2)×1,则n(Cu)×2=n(NO2)×1=0.3mol,所以n(Cu)=0.15mol,所以铜离子浓度为
=0.15mol/L,0.15mol 0.1L
答:所得溶液中Cu2+的物质的量浓度是0.15mol/L;
(3)根据反应:3NO2 +H2O═2HNO3+NO
0.3mol 0.1mol
故最终剩下NO为 0.1mol,体积为2.24L.
答:可收集到气体的体积为2.24L.
