(12分)某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:

⑴放电时,正极的电极反应式为 ;充电时,Pb电极应该连接在外接电源的 (填“正极”或“负极”)。
⑵工业用PbO2来制备KClO4的工业流程如下:
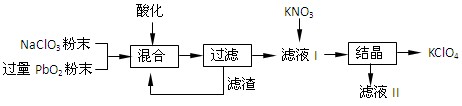
①写出NaClO3与PbO2反应的离子方程式: 。
②工业上可以利用滤液Ⅰ与KNO3发生反应制备KClO4的原因是 。
⑶PbO2会随温度升高逐步分解,称取23.9gPbO2,其受热分解过程中各物质的质量随温度的变化如右图所示。
若在某温度下测得剩余固体的质量为22.94g,则该温度下PbO2分解所得固体产物的组成为 (写化学式),其物质的量之比为 。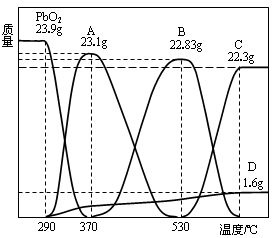
⑴4H++PbO2+2e—=Pb2++2H2O 负极 ⑵①PbO2+ClO3—+2H+=Pb2++ClO4—+H2O
②KClO4的溶解度较小 ⑶Pb2O3和Pb3O4 1:1
(1)放电相当于是原电池,正极得到电子,所以电极反应式为4H++PbO2+2e—=Pb2++2H2O。充电相当于电解池,zau原电池中Pb是负极,失去电子。所以再充电时应该和电源的负极相连,作阴极,得到电子。
(2)①二氧化铅具有氧化性,能把氯酸钠氧化生成高氯酸钠,方程式为
PbO2+ClO3—+2H+=Pb2++ClO4—+H2O。
②由于KClO4的溶解度较小,易结晶析出。
(3)二氧化铅是0.1mol,其中氧原子是0.02mol。再A点,固体减少0.8g,则剩余氧原子的物质的量是0.15mol,剩余此时铅和氧原子的个数之比是2︰3,剩余A点对应点物质是Pb2O3。同理可得出B点对应物质是Pb3O4。由于剩余固体质量介于A和B之间,所以固体是由Pb2O3和Pb3O4组成点混合物。设二者的物质的量分别是x和y,则2x+3y=0.1,3x+4y=0.2-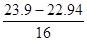 =0.14,解得x=y=0.02mol,所以是1︰1的。
=0.14,解得x=y=0.02mol,所以是1︰1的。
