(12分)浸出-萃取-电积法已成为铜湿法冶金的主要工艺过程。以黄铜铜为原料,采用电积法生产阴极铜生产线,主要生产工艺为:
黄铜铜→硫酸浸出→过滤→萃取→反萃→电积→阴极铜。
(1)浸出是用浸矿剂将铜矿石中的铜进入溶液中。据报道,有一种叫Thibacillus Ferroxidans的细菌在氧气存在下,酸性溶液中,将黄铜矿氧化成硫酸盐,写出用硫酸浸出黄铜矿发生反应的离子方程式: 。
(2)萃取是利用特效铜萃取剂在含铜、铁及其碱性金属离子的低浓度含杂浸出液中有选择性地使铜离子萃入有机相,将铜离子与其它金属离子有效地分离,并通过反萃取使低浓度铜离子的原液富集成适宜电积要求的硫酸铜溶液。萃取过程的化学平衡为:2RH+Cu2+ R2Cu+2H+。则萃取和反萃取进行的程度受 和 的影响。
R2Cu+2H+。则萃取和反萃取进行的程度受 和 的影响。
(3)电积是将萃取富集后的铜溶液电解沉积出阴极铜。右图为用惰性阳极电积阴极铜的装置图:
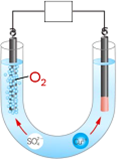
①在图示方框中标出电源的正负极。
②写出电积阴极铜的总反应 。
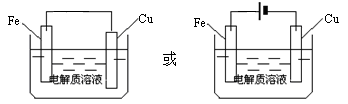
(4)金属铜长期露置于空气中容易生锈,铜锈的主要成分为 ,请利用电化学原理画出防止铜腐蚀的装置图。
⑴4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42+2H2O(2分)
⑵浸出液的pH(1分) 反萃取剂的酸度(1分)
⑶① (2分)
(2分)
②2CuSO4+2H2O 2Cu+O2↑+2H2SO4(2分) ⑷Cu2(OH)2CO3(2分)
2Cu+O2↑+2H2SO4(2分) ⑷Cu2(OH)2CO3(2分)
 (2分)
(2分)
⑴根据提供信息,该反应为黄铜矿、氧气、硫酸发生氧化还原反应,生成硫酸铜、硫酸铁和水。
⑵根据萃取和反萃取的化学平衡,进行的程度受萃取液的pH和反萃取剂的酸度的影响。
⑶电解硫酸铜溶液的反应为2CuSO4+2H2O 2Cu+O2↑+2H2SO4,阳极产生氧气,与电源正极相连,阴极析出铜,与电源负极相连。
2Cu+O2↑+2H2SO4,阳极产生氧气,与电源正极相连,阴极析出铜,与电源负极相连。
⑶铜锈的主要成分为Cu2(OH)2CO3,要保护铜不受腐蚀,装入可以让铜作原电池的正极或电解池的阴极,即可分别利用牺牲阳极的阴极保护法和外接电源的阴极保护法防止金属铜腐蚀。
