(7分)甲、乙两池的电极材料都是铁棒与碳棒(如下图).请回答下列问题:
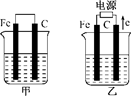
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的________棒;乙池中的________棒.
②在乙池中阴极的电极反应式是________________.
(2)若两池中均盛放饱和NaCl溶液,反应一段时间后:
①写出乙池中发生的总反应的离子方程式____________________.
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化.若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为____________________.
③若乙池转移0.02 mol电子后停止实验,池中溶液的体积是200 mL,则溶液混匀后的pH=________.
(1)①碳(C) 铁(Fe) ②Cu2++2e-===Cu
(2)①2Cl-+2H2O2OH-+H2↑+Cl2↑ ②5Cl2+I2+6H2O===10HCl+2HIO3 ③13
甲池为原电池,乙池为电解池,且甲池中Fe为负极,乙中Fe为阴极,C为阳极。
(1)均盛放CuSO4溶液时,甲池中发生的反应为Fe+Cu2+===Fe2++Cu,乙池中发生的反应为2Cu2++2H2O2Cu+4H++O2↑。
(2)①均盛放NaCl溶液时,甲池中发生吸氧腐蚀,乙池中发生的反应为2Cl-+2H2OCl2↑+H2↑+2OH-,②Cl2再氧化I2,结合物质的量之比为5∶1,利用电子守恒即得出方程式为5Cl2+I2+6H2O===10HCl+2HIO3.③2Cl-+2H2OCl2↑+H2↑+2OH-,因此每生成2 mol OH-,即转移2 mol e-,所以n(OH-)=n(e-)=0.02 mol, c(OH-)=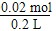 =0.1 mol/L,所以pH=13。
=0.1 mol/L,所以pH=13。
