某兴趣小组采用如下方法制作氢氧燃料电池。
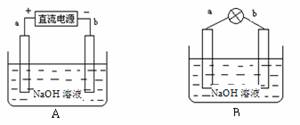
(1)如图A所示:a、b均为多孔石墨棒(多孔石墨棒,可吸附并储存生成的气体),其中a与直流电源正极相连,b与直流电源负极相连,电解质溶液为NaOH溶液,则a电极上发生的电极反应式为_________________,电解后溶液的pH____________(填“增大”、“减小”或“不变”)。
(2)然后如图B所示,移走直流电源,在a、b极间连接一个发光二极管,可以看到二极管发光。此时的电流方向是______________(填“a→b”或“b→a”),b极的电极反应式为______________________________ _。
(3)假设a极吸收22.4L(标准状况)气体,能量转化率为60%,则通过二极管的电子的物质的量为______________。
(1)4OH--4e-=2H2O + O2↑(3分) 增大(2分)
(2)a→b (2分) H2+2OH--2e-=2H2O(3分) (3)2.4mol(2分)
题目分析:(1)a与直流电源正极相连,则a电极是阳极,所以溶液中的OH-放电生成氧气,电极反应式是4OH--4e-=2H2O + O2↑。惰性电极电解氢氧化钠溶液,相当于是电解水,所以氢氧化钠溶液的浓度增大,pH升高。
(2)由于a电极生成氧气,b电极生成氢气,所以此时是氢氧燃料电池,其中a是正极,b是负极,因此电流的方向是a→b;电解质是氢氧化钠溶液,所以负极电极反应式是 H2+2OH--2e-=2H2O。
(3)氧气的物质的量是1mol,在反应中得到4mol电子,由于能量的转化率是60%,因此通过二极管的电子的物质的量是4mol×60%=2.4mol。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。而在电解池中阳极失去,阴极得到电子,如果是惰性电极,则阳极是溶液中的阴离子失去电子,阴极是溶液中的阳离子得到电子,据此可以判断。
