(14分)电化学原理在现代生产生活中有着重要应用。
⑴燃料电池是目前发展势头强劲的优秀绿色环保电池。某新型氢氧燃料电池以H2为燃料,O2为氧化剂,H2SO4溶液为电解液),写出该电池的总反应方程式: 。
⑵铝电池性能优越,Al—AgO电池可用作水下动力电源,该电池反应的原理为:
Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O。
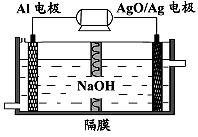
①该电池反应的负极电极反应式 。
②图中隔膜为阴离子交换膜,溶液中OH-通过向 极移动(选填“正”或“负”)。
用Al—AgO电池作为电源,使用Pt电极电解500mL饱和NaCl溶液,电解一段时间后,恢复至室温,所得溶液pH=13(假设NaCl溶液足量且电解前后体积不变)。
③使用Pt电极电解NaCl溶液的离子方程式 ;
电解过程中放出氢气的体积(标准状况下)为 L。
④若电池的效率为50%,该过程中消耗金属铝的质量为 g。
⑶用电解法制取镁时,若原料氯化镁含有水时,在电解温度下,原料会形成Mg(OH)Cl,并发生电离:Mg(OH)C1 = Mg(OH)+ + C1一。
电解时在阴极表面会产生氧化镁钝化膜,此时阴极的反应式为 。
(14分)
⑴ 2H2+O2=2H2O
⑵Al+4OH--3e-=AlO2-+2H2O 负 2Cl-+2H2O  Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
0.56 0.9
⑶2Mg(OH)++2e-=2MgO+H2↑ (每空2分)
题目分析:⑴燃料电池是目前发展势头强劲的优秀绿色环保电池。某新型氢氧燃料电池以H2为燃料,O2为氧化剂,H2SO4溶液为电解液),写出该电池的总反应方程式:2H2+O2=2H2O 。
铝电池性能优越,Al—AgO电池可用作水下动力电源,该电池反应的原理为:
Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O。每消耗1mol铝转移电子是3mol;
①该电池反应的负极是铝,活泼金属能自发和氢氧化钠反应,其电极反应式Al+4OH--3e-=AlO2-+2H2O。
②图中隔膜为阴离子交换膜,溶液中OH-在负极要参与反应,所以向负极移动。
用Al—AgO电池作为电源,使用Pt电极电解500mL饱和NaCl溶液,电解一段时间后,恢复至室温,所得溶液pH=13(假设NaCl溶液足量且电解前后体积不变)。
③使用Pt电极电解NaCl溶液的离子方程式2Cl-+2H2O  Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
;500mL饱和NaCl溶液,电解后pH=13,所以产生的氢氧根物质的量浓度是0.1mol/L;其物质的量是0.05mol;由定量关系可知:生成的氢气是0.025mol。所以电解过程中放出氢气的体积V=22.4n=0.56 L(标准状况下)
④若电池的效率为50%,由电子转移守恒可得:电解时转移电子是0.05mol,所以原电池工作时消耗金属铝的质量为0.9g。
⑶用电解法制取镁时,若原料氯化镁含有水时,在电解温度下,原料会形成Mg(OH)Cl,并发生电离:Mg(OH)C1 = Mg(OH)+ + C1一。
电解时在阴极表面会产生氧化镁钝化膜,此时阴极的反应式为2Mg(OH)++2e-=2MgO+H2↑。
点评:解答此类问题需要注意的是,在原电池和电解池连用时要注意它们之间的唯一联系是电子转移守恒。
