(12分)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
(1)若此蓄电池放电时,该电池某一电极发生还原反应的物质是 (填序号)。
A.NiO2
B.Fe
C.Fe(OH)2
D.Ni(OH)2(2)该电池放电时,正极附近溶液的PH (填增大、减小、不变)
(3)充电时该电池阳极的电极反应式
(4)用此蓄电池分别电解以下两种溶液,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一电极增加了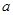 g M,则金属M的相对原子质量为 (用含“
g M,则金属M的相对原子质量为 (用含“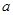 、x”的表达式表示)。
、x”的表达式表示)。
②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100mL,阳极产生的气体在标准状况下的体积是 ;将电解后的溶液加水稀释至1L,此时溶液的PH= 。
(1) A (2) 增大 (3) Ni(OH)2 -2e + 2OH- ="=" NiO2 + 2H2O
(4) 50xa 168ml (无单位不给分) 2
题目分析:(1)得到电子,化合价较低的反应是还原反应,原电池中正极得到电子,发生还原反应,负极失去电子,发生氧化反应,所以根据总的反应式可知,铁是负极,氧化镍是正极,答案选A。
(2)正极是氧化镍得到电子,生成氢氧化镍,电极反应式是NiO2 + 2H2O -2e-=Ni(OH)2 + 2OH-,所以该电池放电时,正极附近溶液的PH增大。
(3)充电相当于放电的逆反应,所以阳极电极反应式就是原电池中正极反应式的逆反应,即Ni(OH)2 -2e + 2OH- ="=" NiO2 + 2H2O。
(4)①根据硝酸盐的化学式可知,M的化合价是+x价,失去0.02mol电子,所以M的相对原子质量是ax÷0.02=50ax。
②阳极首先是氯离子放电生成氯气,然后是OH-放电生成氧气。氯离子的物质的量是0.01mol,失去0.01mol电子,所以OH-失去电子的物质的量是0.02mol-0.01mol=0.01mol,因此氯气是0.005mol、氧气是0.0025mol,在标准状况下的体积是0.0075mol×22.4L/mol=0.168L。阴极铜离子放电,失去0.01mol×2=0.02mol电子,所以此时溶液中的氢离子不放电,因此反应中生成的氢离子的物质的量就是电解硫酸铜溶液时生成的氢离子,物质的量是0.01mol,浓度是0.01mol÷1L=0.01mol/L,pH=2。
点评:在进行电化学的有关计算时,必须准确判断出电极产物,这主要是依据离子的放电顺序进行判断。最后还需要通过电子的得失守恒进行计算。
