(8分)根据下边的实验装置图回答下列问题。
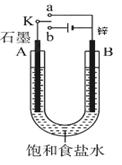
(1)若开始时开关K与a连接,则B极的电极反应式为 ;
(2)若开始时开关K与b连接,则B极的电极反应式为 ;
总反应的化学方程式为 ;
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(1) Zn-2e-=Zn2+ (2)2H++2e-=H2↑ 2NaCl+2H2O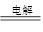 Cl2↑+H2↑+2NaOH ②④
Cl2↑+H2↑+2NaOH ②④
(1)若开始时开关K与a连接,则构成原电池,锌是活泼的金属,所以锌是负极,石墨是正极。其中负极方程式是Zn-2e-=Zn2+。
(2)若开始时开关K与b连接,则构成电解池。B电极和电源的负极相连,作阴极,溶液中的氢离子放电,方程式是2H++2e-=H2↑;阳极是石墨,溶液中的氯离子放电,所以总的反应式是2NaCl+2H2O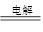 Cl2↑+H2↑+2NaOH;电解池中阳离子向阴极移动,①不正确;氯气具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,②正确;电解中生成的是氢气和氯气,所以要恢复到电解前的状态,应该是通入氯化氢气体,③不正确;氢气是2.24L,在标准状况下是0.1mol,所以转移电子是0.2mol,④正确,答案选②④。
Cl2↑+H2↑+2NaOH;电解池中阳离子向阴极移动,①不正确;氯气具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,②正确;电解中生成的是氢气和氯气,所以要恢复到电解前的状态,应该是通入氯化氢气体,③不正确;氢气是2.24L,在标准状况下是0.1mol,所以转移电子是0.2mol,④正确,答案选②④。
