(15分)对下图中两极加以必要的连接并填空:
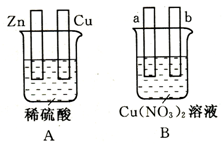
(1)在图A中,使铜片上产生氢气。
①若加以导线连接,则连接后的装置叫 (填“原电池”或“电解池”)。锌片发生 (填“氧化”或“还原”);铜片上的电极反应式: 。
②若外加电源,则连接后的装置叫 (填“原电池”或“电解池”),其中铜片作为该装置的 极,连接电源的 极;锌片上发生的电极反应式为 。
(2)在图B中,使a极析出铜。
①若a、b电极均为石墨电极并加以必要的连接,则连接后的装置应为 (填“原电池”或“电解池”);该装置工作时,溶液中阴离子向 极作定向移动(填“a”或“b”);经过一段时间后,停止反应并搅匀溶液,溶液的酸性 (填“增强”、“降低”或“不变”)。
②若a、b电极加以导线连接,且a极为铜电极,则b极可以为 电极(填序号)。
A.铂
B.铁
C.石墨
D.银 E.锌该装置工作时,溶液中阴离子向 极作定向移动(填“a”或“b”)。
(1) ①原电池(1分);氧化(1分);2H+ + 2e-= H2↑(2分)
②电解池(1分);阴极(1分);负极(1分);Zn- 2e-= Zn2+(2分)
(2) ①电解池(1分); b(1分);增强(1分)
②B、E (2分); b(1分)。
(1)①由于铜不能和稀硫酸反应生成氢气,所以要使铜片上产生氢气,则必须通过原电池或电解池实现;如果是原电池,由于锌比铜活泼,锌是负极失去电子。铜是正极,溶液中的氢离子得到电子,电极反应式是2H+ + 2e-= H2↑。
②外加电源,则连接后的装置叫电解池。此时铜应该和电源的负极相连,作阴极氢离子放电。锌和电源的正极相连,作阳极,失去电子,电极反应式是Zn- 2e-= Zn2+。
(2)①由于a、b电极均为石墨电极,所以是利用电解池实现的。要使a极析出铜,则a电极必须是阴极,和电源的负极相连。则b电极就是阳极,电解池中阴离子向阳极移动。所以溶液中阴离子向b极作定向移动;阳极是OH-放电生成氧气,阴极是铜离子放电析出铜,所以还有硝酸生成,溶液的酸性是增强的。
②若a、b电极加以导线连接,则是通过原电池实现的。要使a极析出铜,则a电极必须是正极,所以b电极的金属性要强于a电极的,因此正确的答案选BE;原电池中溶液中阴离子向负极移动,即向b电极移动。

