(11分)Ⅰ:在H2O2作用下可实现Fe(CN)63-与Fe(CN)64-之间的相互转化,在酸性溶液中H2O2可使Fe(CN)64-转化为Fe(CN)63-;在碱性溶液里H2O2可使Fe(CN)63-转化为Fe(CN)64-。写出以上相互转化的离子方程式。
① 酸性溶液中: ,
②碱性溶液中: 。
Ⅱ:膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。
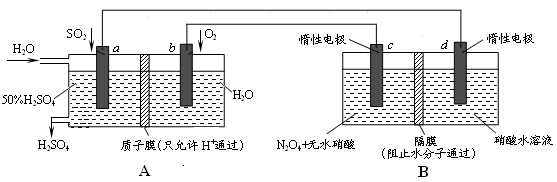
(3)A装置是________,B装置是_________(填“原电池”或“电解池”)。
(4)N2O5在装置中的______区(填“正、负极”或“阴、阳极”)生成,其电极反应式为______________。
(5)通入O2一极的电极反应式为_______________________________。
(1)2Fe(CN)64-+H2O2+2H+====2Fe(CN)63-+2H2O
(2) 2Fe(CN)63-+H2O2+2OH-====2Fe(CN)64-+2H2O+O2↑
(3)原电池 电解池
(4)阳极 N2O4+2HNO3-2e- 2N2O5+2H+
2N2O5+2H+
(5)O2+4H++4e- 2H2O
2H2O
题目分析:1、过氧化氢具有氧化性在酸性条件下将Fe(CN)64-氧化成Fe (CN)63-
在碱性条件下,过氧化氢将氢氧根离子氧化成氧气和水,Fe(CN)63-被还原为Fe(CN)64
3、根据两个装置图可以看到B中两个都是惰性电极,可知其是电解池。A为原电池。
4、氧气通入的一级为正极,可以推出N2O4和无水硝酸在阳极 发生的电极方程式为 N2O4+2HNO3-2e- 2N2O5+2H+
2N2O5+2H+
5、氧气在正极,得到电子被还原为水,O2+4H++4e- 2H2O
2H2O
点评:本题属于中等题,正确判断出N2O4和无水硝酸在阳极反应时解题的关键。