I (6分) A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
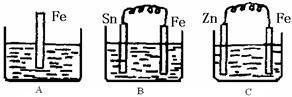
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A ;B ;C 。
(2)一段时间后,三个烧杯中的硫酸恰好全部被消耗,C中产生了3.36L(标准状况)气体,,则原稀硫酸溶液的物质的量浓度= mol·L-1。此时,三个烧杯中液体质量由大到小的顺序为: (填写序号) 。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是 (填写序号)。
Ⅱ(7分)某科研单位利用电化学原理用SO2来制备硫酸,装置如下图,含有某种催化剂。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。

(1)通入SO2的电极为________极,其电极反应式为______________________,此电极区pH________(填“增大”“减小”或“不变”)。
(2)电解质溶液中的H+通过质子膜________(填 “向左”“向右”或“不”)移动,通入氧气的电极反应式为________________________________。
(13分) I (1)A Fe+2H+=Fe2++H2↑。B Fe-2e- ="==" Fe2+ C 2H+ +2e- === H2↑
(2)0.75 mol·L-1。 C> A= B (3)由快到慢的顺序是 BAC (填写序号)。
II (1)负 SO2-2e-+2H2O===SO+4H+(2分) 减小
(2) 向右 O2+4e-+4H+===2H2O (2分) (其余每空1分)
题目分析:I (1)根据装置图的特点可知,A是铁的化学腐蚀,反应的离子方程式是Fe+2H+=Fe2++H2↑;B和C都是原电池,其中B中铁是负极,电极反应式是Fe-2e-=Fe2+;C中铁是正极,溶液中的氢离子放电,电极反应式是2H+ +2e-=H2↑。
(2)氢气的物质的量是3.36L÷22.4L/mol=0.15mol,则根据氢原子守恒可知,稀硫酸的浓度是0.15mol÷0.2L=0.75mol/L。锌的摩尔质量大于铁的,所以三个烧杯中液体质量由大到小的顺序为C>A=B。
(3)A中是化学腐蚀,B中是铁的析氢腐蚀,C中是牺牲阳极的阴极保护法,所以A、B、C中铁被腐蚀的速率,由快到慢的顺序是BAC。
II (1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。在反应中SO2失去电子,所以通入SO2的电极为负极,其电极反应式为O2-2e-+2H2O===SO+4H+,因此此电极区pH减小。
(2)溶液中的阳离子向正极移动,电解质溶液中的H+通过质子膜向右移动,通入氧气的是正极,电极反应式是O2+4e-+4H+===2H2O。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和训练,有利于提高学生的逻辑推理能力和应试能力。本题的关键是注意把握原电池的工作原理,然后结合题意灵活运用即可。
