如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题
(1)该浓盐酸中HCl的物质的量浓度为______mol/L.
(2)配制250mL 0.1mol/L的盐酸溶液
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
| ______ | ______ |
B.将已冷却的盐酸沿玻璃棒注入容量瓶中.
C.用蒸馏水洗涤______2-3次,洗涤液均注入容量瓶,振荡.
D.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处,改用______加水,使溶液凹面恰好与刻度相切.
E.将容量瓶盖紧,振荡,摇匀.
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水______;
②向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,则浓度______;
③定容时俯视容量瓶刻度线______.
(4)实验室里迅速制备少量氯气可利用以下反应:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
此反应不需要加热,常温下就可以迅速进行.
①用“双线桥法”标明电子转移的方向和数目:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
②用该浓盐酸制得了标况下560mlCl2,则被氧化的HCl为______mol,需要KMnO4的质量______g.
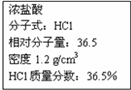
(1)溶液的质量分数和物质的量浓度之间的关系公式c=
=1000ρw% M
=12mol/L,故答案为:12;1000×1.2g/cm3×36.5% 36.5g/mol
(2)盐酸在稀释前后溶质的质量保持不变,设需要浓硫酸的体积为VmL,则1.2×V×36.5%=0.25×0.1,解得V=2.1mL,溶液的体积和容量瓶的规格相符,故选择250mL的容量瓶,固体的溶解使用少白,定容时采用胶头滴管,故答案为:2.1;250;烧杯;胶头滴管;
(3)①将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水,还要进行定容,所以对实验结果无影响;
②向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,那么溶质有损失,所以导致溶质质量减少,故则浓度偏小;
③定容时俯视容量瓶刻度线,导致溶液的体积减小,所以溶液浓度偏大;
故答案为:①无影响; ②偏低;③偏高;
(4)①氧化还原反应中,化合价升高值=化合价降低值=转移电子数=10,电子转移情况如下,
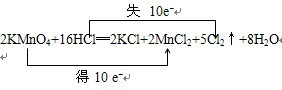
,
故答案为:

;
②在反应中,每生成5mol的氯气,就会有16mol的盐酸参加反应,盐酸表现还原性和酸性,其中有10mol的盐酸表现还原性,被氧化,当生成氯气0.025mol时,则消耗的盐酸物质的量为
0.08mol,被氧化的盐酸为0.05 mol,消耗高锰酸钾的质量是0.01mol×316g/mol=3.16g,故答案为:0.05;3.16.
