下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。
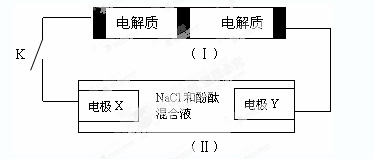
装置(Ⅰ)的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为2Na2S2+NaBr3化气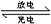 Na2S4+3NaBr。当闭合开关K时,X电极附近溶液变红。下列说法正确的是
Na2S4+3NaBr。当闭合开关K时,X电极附近溶液变红。下列说法正确的是
A.闭合开关K时,钠离子从右到左通过离子交换膜
B.闭合开关K时,负极反应式为:3NaBr-2e-=NaBr3+2Na+
C.闭合开关K时,X电极反应式为:2Cl--2e-=Cl2↑
D.闭合开关K时,当有0.1molNa+通过离子交换膜,X电极上析出标准状况下气体1.12L
答案:D
题目分析:当闭合开关K时,X极附近溶液变红色,说明X极生成OH-离子,为电解池的阴极,发生反应为2H2O+2e-=H2↑+2OH-。则A为原电池的负极,B为原电池的正极,根据电池充、放电的化学反应方程式为2Na2S2+NaBr3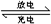 Na2S4+3NaBr可知,负极反应为2Na2S2-2e-=2Na++Na2S4,正极反应为NaBr3+2Na++2e-=3NaBr,Y极为电解池的阳极,电极反应为2Cl――2e-=Cl2↑,以此解答该题。
Na2S4+3NaBr可知,负极反应为2Na2S2-2e-=2Na++Na2S4,正极反应为NaBr3+2Na++2e-=3NaBr,Y极为电解池的阳极,电极反应为2Cl――2e-=Cl2↑,以此解答该题。
A、原电池中阳离子向正极移动,则闭合K时,钠离子从左到右通过离子交换膜,故A错误; B、闭合K时,负极发生氧化反应,电极反应为2Na2S2-2e-=2Na++Na2S4,故B错误;
C、闭合K时,X极附近溶液变红色,说明X极生成OH-离子,为电解池的阴极,发生反应为2H2O+2e-=H2↑+2OH-,故C错误;
D、闭合K时,有0.1molNa+通过离子交换膜,说明有0.1mol电子转移,阴极上生成0.05molH2,标准状况下体积为0.05mol×22.4L/mol=1.12L,故D正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,试题以新科技新发明为载体,有利于培养学生的学习兴趣,激发学生的学习积极性。答题时注意从总反应式判断两极上的变化和电极反应式的书写。明确原电池和电解池的工作原理是答题的关键。
