如图为实验室某试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
| 氢氧化钠溶液 分子式:NaOH 相对分子质量:40 密度:1.2g•cm-3 质量分数:20% |
(2)现在要配制该浓度的NaOH溶液100ml,需称量______g固体氢氧化钠.溶液配制的所需的基本步骤如下:
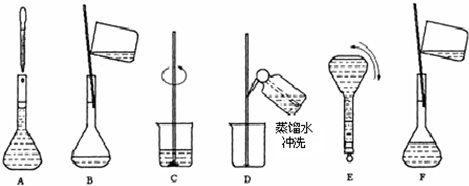
(3)将上述实验步骤A到F按实验过程先后次序排列______.
(4)上述实验步骤A、B、E、F都用到的仪器名称为______.
(5)下列操作对NaOH溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”).
①摇匀后发现液面低于刻度线再加水______;
②容量瓶中原有少量蒸馏水______;
③定容时俯视观察液面______.
(1)该NaOH溶液的物质的量浓度为:
mol/L=6mol/L,故答案为:6;1000×1.2×20% 40
(2)配制6mol/L的NaOH溶液100ml需要氢氧化钠的质量为:0.1L×6mol/L×40g/mol=24.0g,故答案为:24.0;
(3)溶液配制步骤:计算→称量→溶解→冷却→转移→洗涤→定容→摇匀,故溶液配制实验过程先后次序排列为:CBDFAE,故答案为:CBDFAE;
(4)由图可知,上述实验步骤A、B、E、F都用到的仪器名称为100ml容量瓶,故答案为:100ml容量瓶;
(5)①摇匀后发现液面低于刻度线,少量溶液残留在瓶塞与瓶口之间,再加水至刻度线,导致所配溶液的体积偏大,配制溶液的浓度偏低,
故答案为:偏低;
②溶液配制需加水定容,容量瓶中原有少量蒸馏水,对所配溶液无影响,故答案为:无影响;
③定容时俯视观察液面,导致所配溶液的体积偏小,配制溶液的浓度偏高,故答案为:偏高.
