下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
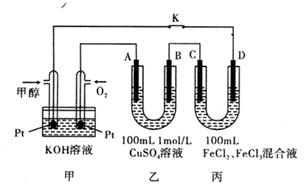
(1)甲中负极的电极反应式为____ 。
(2)乙中A极析出的气体在标准状况下的体积为____ 。
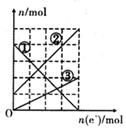
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系右图,则图中②线表示的是 离子的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要 mL 5.0 mol/L NaOH溶液。
⑴CH3OH―6e―+8OH―=CO32―+6H2O(2分)⑵2.24L(2分,数值正确无单位得1分)⑶Fe2+(2分)280(2分)
A、甲中负极是甲醇,碳为-2价,氧化产物为CO32―,电极反应为:CH3OH―6e―+8OH―=CO32―+6H2O,答案:CH3OH―6e―+8OH―=CO32―+6H2O;⑵A上先发生Cu2++2e―=Cu,转移电子0.2mol,B生成O2为0.2mol/4=0.05mol,后A上发生2H+ +2e―=H2,令产生的H2为xmol,B上生成的O2为x/2mol,A、B两极上产生的气体体积相同,xmol=x/2mol+0.05mol,x=0.1mol,A产生的气体在标准状况下的体积为2.24L,⑶由⑵转移的电子数为0.4mol,丙中反应方程式为:Cu+2Fe3+=2Fe2++Cu2+,①为Fe3+ 共0.4mol,反应后生成Fe2+0.4mol,从图中可知原来Fe2+ 有0.1mol, ②为Fe2+ 共0.5mol,③为Cu2+ ,共0.2mol, 加入NaOH为(0.5mol×2+0.2mol×2)÷ 5.0 mol/L=280mL,答案:Fe2+ ,220mL.
考点:原电池,电解池综合计算