新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源进行氯化镁溶液龟解实验,电解装置如图所示。
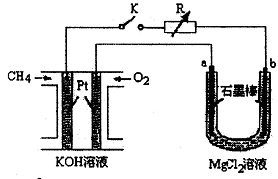
请回答下列问题:
(1)甲烷燃料电池负极的电极反应式为: 。
(2)闭合开关K后,a、b电极上均有气体产生,其中a电极上的气体可用 检验,b电极上得到的气体是 ,电解氯化镁溶液的离子方程式为 。
(3)若甲烷通入量为1.12 L(标准状况),且反应完全,则理论上通过电解池的电子的物质的量为 ,产生的氯气体积为 L(标准状况)。
(4)已知常温常压下,0.25molCH4完全燃烧生成CO2和H2O时,放出222.5kJ热量,请写出CH4燃烧热的热化学方程式 。
已知;①C(石墨)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ/mol
计算:C(石墨)与H2(g)反应生成1molCH4(g)的△H= 。
(1)CH4+ 10OH――8e- = CO32-+7H2O
(2)湿润的淀粉碘化钾试纸 氢气 Mg2++2Cl-+2H2O = Mg(OH)2+ H2↑+Cl2↑
(3)0.4mol 4.48L
(4)CH4(g)+2O2(g)=CO2(g)+ 2H2O(l) △H= -890kJ/mol -75.1kJ/mol
题目分析:该装置中左边是原电池,右边是电解池,a为阳极,b为阴极。(1)甲烷在碱性条件下失去电子,电极反应式为CH4+ 10OH――8e- = CO32-+7H2O;(2)a极产生氯气,用湿润的淀粉碘化钾试纸检验;b极H+放电,产生氢气,电解方程式为Mg2++2Cl-+2H2O = Mg(OH)2+ H2↑+Cl2↑;
(3)n(e-)=1.12÷22.4×8=0.4mol v(Cl2)=0.4÷2×22.4=4.48L
(4)0.25molCH4完全燃烧生成CO2和H2O时,放出222.5kJ热量,
1molCH4完全燃烧放出热量为222.5×4=890kJ,燃烧热热化学方程式为
CH4(g)+2O2(g)=CO2(g)+ 2H2O(l) △H= -890kJ/mol
△H=△H1+△H2-甲烷燃烧热=-75.1kJ/mol
