第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
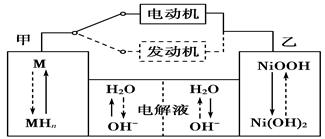
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为H2+2NiOOH 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,甲电
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,甲电
极周围溶液的pH________(填“增大”“减小”或“不变”),该电极的电极反应_________。

(2)Cu2O是一种半导体材料,可通过如图所示的电解装置制取,电解总反应式为
2Cu+H2O Cu2O+H2↑,阴极的电极反应式是_____________________。
Cu2O+H2↑,阴极的电极反应式是_____________________。
用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为______g。
(3)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的________腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,该方法叫 ________。
(1)减小H2-2 e-+2 OH-=2H2O (2)H2O+2e-= H2↑+O2- 144
(3)吸氧 牺牲阳极的阴极保护法
题目分析:甲:电极为储氢金属作负极,该电极失去电子,发生的电极反应为:H2-2e-+2OH-=2H2O,消耗了氢氧根离子,使氢氧根离子的浓度减小,所以溶液的PH减小。(2)由电解的总方程式可知铜在阳极失去电子,发生氧化反应: 2Cu-2e-+O2-=Cu2O;水电离产生的氢离子在阴极得到电子,发生还原反应:H2O+2e-= H2↑+O2-。根据电解的化学方程式可看出:产生1ml氢气,同时得到1mol Cu2O,其质量为144g。(3)钢铁在酸性环境发生析氢腐蚀,在中性环境中发生吸氧腐蚀。由于海水是中性环境,所以发生吸氧腐蚀。为保护船体,在浸泡在海水里的船体熵连接锌块,这样由于锌比铁活泼,腐蚀的是锌,对船体就起到了保护作用。这种方法叫牺牲阳极的阴极保护法。
