问题
填空题
二氧化碳的“捕捉”与“封存”是实现温室气体减排的重要途径之一。实际生产中,经常利用足量NaOH溶液来“捕捉”CO2,流程图如下(部分条件及物质未标出)。
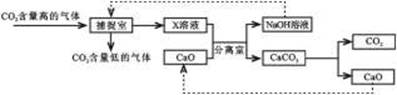
(1)分离室中进行的操作是____________。
(2)该流程图所标出的物质中,溶于水放出大量热的氧化物是__________。
(3)“捕捉室”内发生反应的化学方程式为_____________________________。
(4)将CaO加入到x溶液中,其中发生复分解反应的化学方程式是_______________________________。
答案
(1)过滤 (2)CaO(或氧化钙)
(3)CO2+2NaOH=Na2CO3+H2O
(4) Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
从图中可知,“捕捉室”内发生的反应为二氧化碳与氢氧化钠溶液反应,即:CO2+2NaOH=Na2CO3+H2O;所以X溶液应为Na2CO3溶液。
CaO遇水会和水反应生成Ca(OH)2,同时放出大量的热。
生成的Ca(OH)2与Na2CO3进行反应:Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
在分离室中将上面反应生成的CaCO3(固体沉淀)和NaOH(溶液)分离开,因此操作为过滤。
点评:本题在利用化学反应将二氧化碳进行分离,以达到捕捉和封存的目的。可根据二氧化碳的性质进行回答。
