(10分)电解原理和原电池原理是电化学的两个重要内容。某兴趣小组做如下探究实验:
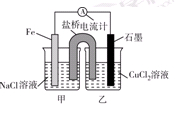
Ⅰ.(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)_______________________________设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________________________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因____________________________________________。
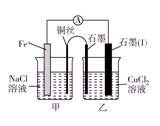
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨(1)为________极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为_________________________________。
Ⅱ.如右图所示装置,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL。
请完成下列问题:
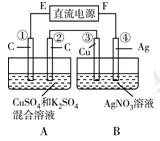
①第②极上生成的物质为________mol。
②写出第①极上发生反应的电极反应式_________________________。
③设A池中原混合液的体积为200 mL,则通电前A池原混合液中Cu2+的浓度为________ mol/L。
Ⅰ.(1)Fe+Cu2+=Fe2++Cu 0.2
(2)2H++2e-=H2↑ 酸性 NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(3) 阴 2Cl--2e-=Cl2↑
Ⅱ.(1)①0.005 ②Cu2++2e-=Cu 2H++2e-=H2↑(共1分) ③0.025
题目分析:Ⅰ.由图可知该装置为原电池,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
12g n
n=0.2mol
(2)若将CuCl2溶液换为NH4Cl溶液,溶液呈酸性,发生:NH4++H2O⇌NH3•H2O+H+,负极发生2H++2e-═H2↑,负极发生Fe-2e-=Fe2-。
(3)将盐桥换成弯铜导线与石墨相连成n型,则甲装置为原电池,铁做负极,铜为正极。乙装置为电解池,石墨(1)为阴极,乙装置中与铜线相连石墨电极为阳极。发生的反应式为2Cl--2e-=Cl2↑
Ⅱ.由图可知,B装置为电解池,第③极增重2.16g,发生Ag++e-=Ag,n(Ag)=0.02mol,则转移电子为0.02mol,
A池中收集到标准状况下的气体224mL,所以气体的物质的量为0.224L/22.4L/mol=0.01mol,
A装置中阳极发生4OH--4e-=O2↑+2H2O,转移0.02mol电子。第②极生成气体为0.005mol,
所以第①极上发生反应的电极反应式为
2H++2e-=H2↑,
0.01 0.005
Cu2++2e-=Cu
0.005 0.01
即Cu2+的物质的量为(0.02−0.005×2)/ 2=0.005mol,
c(Cu2+)=0.005mo/l0.2L=0.025mol/L。
