如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题:
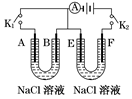
(1)打开K2,闭合K1,B为_______极,A的电极反应为_____,最终可观察到的现象是 。
(2)打开K1,闭合K2,E为_______极,检验F极产生气体的方法是 。该装置中发生反应的化学方程式为_________。
(3)若往U型管中滴加酚酞,进行(1)、(2)操作时, 极周围能变红(填A、B、E、或F)。
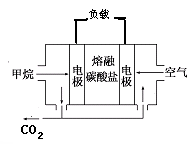
(4)若电源选用燃料电池,结构如下图,以熔融碳酸盐为电解质(非水溶济,能够传导CO32-),电池工作时电解质组成保持稳定,通入甲烷的电极为________极,请写出正极反应的方程式 ,若在标况下消耗11.2L的甲烷,电解NaCl溶液产生的H2的物质的量为 mol(假设燃料电池能量转化率为75%)。
(1)负;(2分)O2+2H2O+4e-===4OH-;(2分)溶液中有红褐色沉淀生成(2分)(2)阴;(2分)用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,
证明是氯气(2分)2NaCl+2H2O 2NaOH+H2↑+Cl2↑(2分)(3)A、E;(4分)
2NaOH+H2↑+Cl2↑(2分)(3)A、E;(4分)
(4)负(2分) 2CO2+O2+4e-=2CO32-(2分);1.5(3分)
题目分析:(1)打开K2,闭合K1,则构成原电池,铁是负极,即B是负极,A是正极。此时发生铁的吸氧腐蚀,所以最终溶液中有红褐色氢氧化铁沉淀生成。
(2)打开K1,闭合K2,则构成电解池。E和电源的负极相连,作阴极,溶液中的氢离子放电。F和电源的正极相连,是阳极,溶液中的氯离子放电生成氯气。氯气具有氧化性,可用湿润的淀粉碘化钾试纸检验。
(3)根据以上分析可知,进行(1)、(2)操作时,OH-分别在A和E极产生,所以在这两极溶液显红色。
(4)原电池中负极失去电子,发生氧化反应,甲烷在反应中被氧化,失去电子,所以在负极通入,空气在正极通入。由于电解质是熔融盐,能传递能够传导CO32-,所以正极的电极反应式为2CO2+O2+4e-=2CO32-。1mol甲烷在反应中失去8mol电子,11.2L甲烷是0.5mol,共转移电子4mol。根据得失电子守恒可知生成氢气是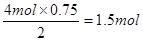 。
。
