(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。(填字母)
A.C(s)+CO2(g)="2CO(g)" △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2CO(g)+O2(g)=2CO2(1)△H<0
(2)以KOH溶液为电解质溶液,依据(1)中所选反应设计一个原电池, 其正极的电极反应式为: 。
(3)利用下图装置,可以模拟铁的电化学防护。 若X为碳棒,为减缓铁的腐蚀,开关K应该置于 (填M或者N)处,此时溶液中的阴离子向 极(填X或铁)移动。若X为锌,开光K置于M处,该电化学防护法称为: 。
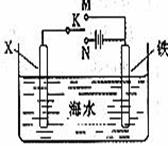
(1)C;(2)O2+2H2O+4e- = 4OH-;(3)N;X ;牺牲阳极的阴极保护法
题目分析:(1)根据原电池原理和题给信息知,能设计成原电池的反应必须是放热的氧化还原反应,A为吸热反应,B为复分解反应,C为放热的氧化还原反应,所以C符合原电池设计原理的要求,选C;
(2)将反应2CO(g)+O2(g)=2CO2(l)△H<0,设计成原电池,该电池为燃料电池。依据原电池原理:负极区发生氧化反应,正极区发生还原反应知,燃料CO在负极区反应,助燃剂O2在正极区参加反应,结合以KOH溶液为电解质溶液,其正极电极反应式为:O2+2H2O+4e- = 4OH-;
(3)装置图X为碳棒,若减缓铁的腐蚀,在原电池中铁做正极,电解池中铁做阴极;若置于M处形成原电池,铁做原电池负极被腐蚀,所以K应放置N处,形成电解池,铁做阴极被保护,溶液中阴离子移向阳极碳棒X;若X为锌,开光K置于M处,形成原电池,铁做原电池的正极被保护,该电化学防护法称为牺牲阳极的阴极保护法。
