问题
填空题
按如图所示装置连接,X、Y均为惰性电极。请回答下列问题:
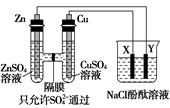
(1)Zn为________极。
(2)连接好装置后,烧杯中的溶液发生反应的离子方程式是___________。
(3)图中通过隔膜的SO42-向________(填“左”“右”或“不”)迁移,Y极及其附近出现的现象是________。
(4)常温下,当Zn极质量减少32.5 g时,X极生成气体8.4 L(标准状况),若此时烧杯中溶液的体积为500 mL,则此时烧杯中溶液的pH=________(不考虑生成的气体溶于水)。
答案
(1)负
(2)2H2O+2Cl- H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
(3)左 有气泡产生,溶液呈红色
(4)14
经分析可知,左侧为原电池,右侧为电解池。(1)Zn为负极。(2)烧杯中是电解氯化钠溶液,离子方程式为2H2O+2Cl- H2↑+Cl2↑+2OH-。(3)Zn为负极,失电子生成Zn2+进入溶液,SO42-通过隔膜向左移动;烧杯中Y极有氢气逸出,同时有OH-生成,酚酞溶液呈红色。(4)锌是原电池的负极,Y是电解池的阴极;铜是原电池的正极,X是电解池的阳极。X电极有氯气逸出,直到NaCl电解完全,接下来就是电解NaOH,逸出O2。Zn减少0.5 mol,转移电子为1 mol,如果全部生成氯气则有0.5 mol氯气生成,如果全部生成氧气,则有0.25 mol氧气生成。根据电子得失守恒和气体体积可得:Cl2为0.25 mol,O2为0.125 mol。计算可知,c(OH-)=1 mol/L,pH=14。
H2↑+Cl2↑+2OH-。(3)Zn为负极,失电子生成Zn2+进入溶液,SO42-通过隔膜向左移动;烧杯中Y极有氢气逸出,同时有OH-生成,酚酞溶液呈红色。(4)锌是原电池的负极,Y是电解池的阴极;铜是原电池的正极,X是电解池的阳极。X电极有氯气逸出,直到NaCl电解完全,接下来就是电解NaOH,逸出O2。Zn减少0.5 mol,转移电子为1 mol,如果全部生成氯气则有0.5 mol氯气生成,如果全部生成氧气,则有0.25 mol氧气生成。根据电子得失守恒和气体体积可得:Cl2为0.25 mol,O2为0.125 mol。计算可知,c(OH-)=1 mol/L,pH=14。
