(1)一定条件下,在容积为2L的密闭容器中加入一定量的A,发生如下反应并建立平衡:A(g)⇌2B(g) 2B(g)⇌2D(g)+C(g)测得平衡时各物质的浓度是:c(A)=0.3mol•L-1,c(B)=0.2mol•L-1,c(C)=0.05mol•L-1,则最初加入的A物质的量是______
A.0.8molB.0.5molC.0.9molD.1.2mol
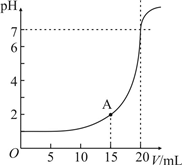
(2)如图为10mL一定物质的量浓度的HCl溶液用一定物质的量浓度的NaOH溶液滴定的图示.请根据图示计算:
①氢氧化钠物质的量浓度是多少?______
②A的pH值:______
(3)已知硼(B)可形成化合物BCl3,该分子的所有原子最外层是否满足八电子稳定结构______(填“是”或“否”).BCl3在潮湿空气中会产生大量白雾,试写出其反应的化学方程式______.
(4)已知锌锰干电池的总式为:Zn+2MnO2+2NH4Cl=Mn2O3+ZnCl2+2NH3+2H2O则该电池的正极反应式为______.
(1)2B(g)⇌2D(g)+C(g)
转化:0.1mol/L 0.05mol/L
剩余:0.2mol/L
起始:0.3mol/L
则 A(g)⇌2B(g)
转化:0.15moL/L 0.3moL/L
剩余:0.3mol/L
起始:0.45mol/L
所以最初加入的A物质的量是0.45mol/L×2L=0.9mol,
故答案为:C;
(2)①由图象可知盐酸的pH=1,则c(H+)=0.1mol/L,加入NaOH20mL时溶液呈中性,
则有c(NaOH)=
=0.05mol/L,0.01L×0.1L/mol 0.02L
故答案为:0.05 mol/L;
②A点时加入NaOH15mL,
则c(H+)=
=0.02mol/L,则pH=2,0.01L×0.1L/mol-0.015L×0.05mol/L 0.025L
故答案为:2;
(3)BCl3中,B的最外层电子数为3+3=6,不满足8电子稳定结构,
BCl3在潮湿空气中会产生大量白雾,说明生成HCl,为水解反应,反应的化学方程式为BCl3+3H2O═3HCl↑+H3BO3,
故答案为:否;BCl3+3H2O═3HCl↑+H3BO3;
(4)原电池正极发生还原反应,结合电池反应式可知正极反应为2MnO2+2NH4++2e-═Mn2O3+H2O+2NH3,
故答案为:2MnO2+2NH4++2e-═Mn2O3+H2O+2NH3.
