“84消毒液”能有效杀灭甲型H1N1等病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1000mL、密度1.19g•cm-3,稀释100倍(体积比)后使用.
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为______mol•L-1.
(2)该同学取100mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)≈______mol•L-1(假设稀释后溶液密度为1.0g•cm-3).
(3)一瓶“威露士”牌“84消毒液”能吸收______L空气中的CO2(标准状况)而变质.
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480mL含25%NaClO的消毒液.下列说法正确的是______(填编号).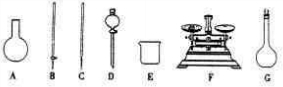
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143g.
(1)根据c=
,则c(NaClO)=1000ρw M
=4.0mol•L-1,故答案为:4.0;1000mL×1.19g•cm-3×25% 74.5g•mol-1×1L
(2)根据稀释前后溶质的物质的量不变,则100mL×4.0mol•L-1=
×c(NaClO),100mL×1.19g•cm-3+10000g 1g•cm-3
解得稀释后c(NaClO)≈0.04mol•L-1,c(Na+)=c(NaClO)≈0.04mol•L-1,故答案为:0.04;
(3)一瓶“84消毒液”含有n(NaClO)=1L×4.0mol•L-1=4.0mol,
根据反应CO2+2NaClO+H2O═Na2CO3+2HClO,则需要CO2的物质的量为n(NaClO)×
=2.0mol,1 2
即标准状况下V(CO2)=2.0mol×22.4L•mol-1=44.8L,故答案为:44.8L;
(4)A、需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、C、D不需要,但还需玻璃棒和胶头滴管,故A错误;
B、配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;
C、由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;
D、应选取500mL的容量瓶进行配制,然后取出480mL即可,所以需要NaClO的质量:0.5L×4.0mol•L-1×74.5g•mol-1=149g,故D错误;
故答案为:C.
