问题
推断题
(8分)二氧化碳的“捕捉”与“封存”是实现温室气体减排的重要途径之一。实际生产中,经常利用足量NaOH溶液来“捕捉”CO2,流程图如下(部分条件及物质未标出)。
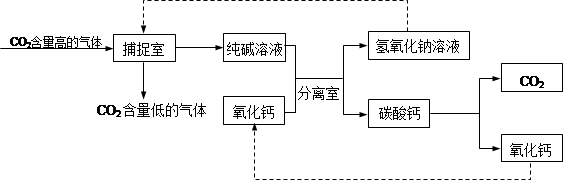
①图中标出的物质中,属于碱类物质的化学式为 ;
②该流程图所标出的物质中,溶于水放出大量热的氧化物是 ,与水发生反应的化学方程式为 ;
③“捕捉室”中发生的的化学方程式为 ,整个“捕捉”过程中,可循环使用的物质是 和 。
答案
① NaOH ②CaO CaO + H2O=Ca(OH)2
③CO2 +2 NaOH=Na2CO3 + H2O NaOH、CaO
题目分析:①纯碱是碳酸钠,和碳酸钙一样都是属于盐,氧化钙和二氧化碳都是氧化物,属于碱的是氢氧化钠,化学式为:NaOH
②氧化钙溶于水,会与水反应,并且放出大量的热,化学方程式为:CaO + H2O=Ca(OH)2
③“捕捉室”中通入二氧化碳进去后,得到纯碱溶液,所以发生的的化学方程式为:CO2 +2 NaOH=Na2CO3 + H2O,可循环使用的物质可以直接从流程图中可以看出,NaOH和CaO既作为反应,又作为生成物,所以可以循环使用
