已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下

回答下列问题:
(1)加入CuO的作用是_______________________。
(2)步骤②中所用的部分仪器如下图所示,则A、B分别连直流电源的__________和__________极(填“正”或“负”)。
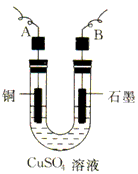
(3)电解开始后,在U形管中可以观察到的现象有:________________________
电解的离子方程式(总反应)为________________________。
(4)下列实验操作中必要的是____________(填写字母)。
(A)称量电解前的电极的质量;
(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;
(C)刮下电解后电极上析出的铜,并清洗,称量;
(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→ 再称量”进行;
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为_______________________(用带有n、V的计算式表示)。
(1)通过消耗H+而调整溶液的pH使之升高,其目的是使Fe3+完成水解形成Fe(OH)3沉淀而除去
(2)负;正
(3)石墨上有气泡逸出,溶液颜色变浅;2Cu2++2H2O==2Cu↓+O2↑+4H+
(4)ABDE
(5)11200n/V
