甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
CO(g)+2H2(g)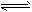 CH3OH(g)。
CH3OH(g)。
(1)分析该反应并回答下列问题:
①平衡常数表达式为K=____________。
②下列各项中,不能说明该反应已达到平衡的是________(填序号)。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2 mol CO,同时生成1 mol CH3OH
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
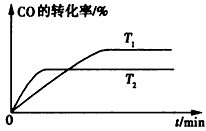
①该反应的焓变△H____(填“>”、“<”或 “=”)0。
②T1和T2温度下的平衡常数大小关系是K1____ (填“>”、“<”或“=”)K2。
③若容器容积不变,下列措施可增加甲醇产率的是____
a.升高温度
b.将CH3OH(g)从体系中分离出来
c.使用合适的催化剂
d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-a kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ/mol
③H2O(g)=H2O(l) △H=-c kJ/mol
则CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H =____kJ/mol。
(4)已知甲醇燃料电池的工作原理如图所示。
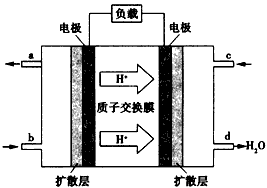
①该电池工作时,b口通入的物质为____,c口通入的物质为____。
②该电池正极的电极反应式为:________________。
③工作一段时间后,当6.4g甲醇完全反应生成CO2 时,有____NA个电子发生转移。
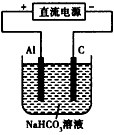
(5)用上述电池作电源,用如图所示 装置进行实验,发现实现过程中,溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):_____________________
(1)① ;②d
;②d
(2)①<;②>;③b
(3)(b-a-4c)/2
(4)①CH3OH;O2;②O2+4e-+4H+=2H2O;③1.2
(5) Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+3CO2↑

 冠折,露髓,
冠折,露髓, 折断面至龈下2.5mm,X线片显示,
折断面至龈下2.5mm,X线片显示, 折断面平齐龈缘,根长11mm,
折断面平齐龈缘,根长11mm,