工业上处理含Cr2O72-的酸性工业废水用以下方法:
①往工业废水中加入适量的NaCl,搅拌均匀;
②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成;
③ 过滤回收沉淀,废水达排放标准,试回答:
(1)电解时的电极反应,阳极___,阴极___。
(2)写出Cr2O72-转变成Cr3+的离子方程式____。
(3)电解过程中Cr(OH)3和Fe(OH)3沉淀是怎样产生的?__________________
(4)能否将Fe电极改成石墨电极?为什么?__________________
(1)Fe-2e-=Fe2+ ;2H++2e-=H2↑
(2) 6Fe2+ +Cr2O72- +14H+=6Fe3+ +2Cr3+ +7H2O
(3)由于阴极H+放电,破坏了水的电离平衡,H2O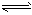 H++OH-, c(OH-)逐渐增大并向阳极移动,与
H++OH-, c(OH-)逐渐增大并向阳极移动,与
Fe3+ 、Cr3+形成Fe(OH)3、 Cr(OH)3沉淀。
(4)不能用石墨电极代替Fe电极。因为Fe电极在电解过程中产生还原性的Fe2+ ,将溶液中Cr2O72-还原为
Cr3+ 而除去,若改用石墨电极,阳极产生的是Cl2,不能将Cr2O72-还原为Cr3+。
