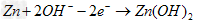Ⅰ:钛(Ti)被称为继铁、铝之后的第三金属,钝钛和以钛为主的合金是新型的结构材料,主要用于航天工业和航海工业,下列是有关钛的冶炼及应用的问题。
(1)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2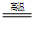 TiCl4+2CO
TiCl4+2CO
已知:C(S)+O2(g)=CO2(g) H=-393.5 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) H=-566 kJ·mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) H=+141 kJ·mol-1
则TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的 H=______________。
(2)钠热还原法是冶炼金属钛的方法之一,主要反应原理为:4Na+TiCl4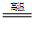 4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因是____________(用化学方程式说明)。
4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因是____________(用化学方程式说明)。
Ⅱ:高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
(3)高铁酸钠是一种新型净水剂,在水中可以发生如下反应: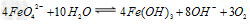 。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________________ 。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________________ 。
(4)高铁电池是一种新型可充电电池,电解质为碱溶液,其反应式为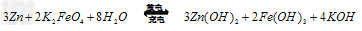 则电池正极材料是_________,充电时电池正极___________(填“得”“失”)电子,放电时电池的负极反应式为 ____________。
则电池正极材料是_________,充电时电池正极___________(填“得”“失”)电子,放电时电池的负极反应式为 ____________。
Ⅰ:(1)-80 kJ·mol-1
(2)2Na+2H2O=2NaOH+H2
Ⅱ:(3)氧化性 ;FeO42-被还原生成的Fe3+会发生水解形成Fe(OH)3胶体能吸附水中的悬浮杂质
(4) K2FeO4 ;失 ;