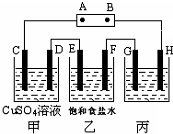
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、G、H 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
(1)电源A 极的名称______.
(2)甲装置中C极反应式______.
(3)E极反应式______.在C、D、E、F各电极上析出生成物的物质的量比是______
(4)欲用丙装置精炼粗铜,G应该是______(填“纯铜”或“粗铜”);欲用丙装置向铁棒上镀铜,H应该是______(填“铜”或“铁”),开始G、H两极材料质量相同,电镀一段时间后,两极质量之差为2.56g,则经过电路中电子数目为______.
(1)根据题意知,F极有氢离子得电子析出氢气,所以F极是阴极,与阴极相连的原电池电极是负极,所以B是负极,A是正极,故答案为:正极;
(2)甲装置中C极是阳极,阳极上失电子发生氧化反,溶液中氢氧根离子的放电能力大于硫酸根离子,所以在C极上氢氧根离子放电生成水和氧气,电极反应式4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
(3)通过(1)知,F是阴极,所以E是阳极,溶液中氯离子的放电能力大于氢氧根离子,所以氯离子在E极上失电子生成氯气,电极反应式为2Cl--2e-=Cl2↑,
在阳极上失电子阴极上得电子,甲装置中氢氧根的失电子能力大于硫酸根离子,铜离子得电子能力大于氢离子得电子能力,乙装置中氯离子失电子能力大于氢氧根离子,
氢离子得电子能力大于钠离子,所以在C、D、E、F分别析出氧气、铜、氯气、氢气;电解时,通过的电子数相同,通过相同数目的电子时析出氧气、铜、氯气、氢气的物质的量
之比为1:2:2:2,故答案为:2Cl--2e-=Cl2↑;1:2:2:2;
(4)电镀时,镀层作阳极,所以G应是粗铜;镀件作阴极,铁作镀件,所以H是铁;
电镀时,阳极上铜失电子生成铜离子进入溶液,所以质量减少,阴极上铜离子得电子生成铜,质量增加,
所以两极质量差为阳极减少的质量加上阴极增加的质量.
设通过x个电子,铜质量与电子的关系为:
2Cu--2e-
128g 2N A
2.56g x
所以x=0.04N A
故答案为:粗铜;铁;0.04N A.
