问题
选择题
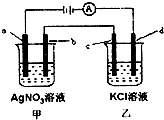
如图,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
A.甲、乙两烧杯中溶液的pH均升高
B.当b极增重5.4g时,d极产生的气体为2.24L(标准状况)
C.当电解一段时间后,将甲、乙两溶液混合,一定会生成沉淀
D.乙烧杯中c的电极反应式为2Cl--2e-=Cl2↑
答案
根据电解装置可以知道a是阳极,b是阴极,c是阳极,d是阴极.
A、电解硝酸银的产物是金属银、硝酸和氧气,溶液的pH降低,电解氯化钾的产物是氢氧化钾、氢气和氯气,溶液的
pH升高,故A错误;
B、b电极上发生的反应为:Ag++e-=Ag,当b极增重5.4g时,即生成金属银0.05mol,转移电子为0.05mol,d电极上发生的反应为:2H++2e-=H2↑,当转移电子0.05mol时,生成氢气0.025mol,体为0.56L,故B错误;
C、当电解一段时间后,甲装置产物是金属银、硝酸和氧气,乙装置产物是氢氧化钾、氢气和氯气,将甲、乙两溶液混合,主要是硝酸和氢氧化钾的反应,无沉淀生成,故C错误;
D、乙烧杯中,c极是阳极,其电极反应式为2Cl--2e-=Cl2↑,故D正确.
故选D.
