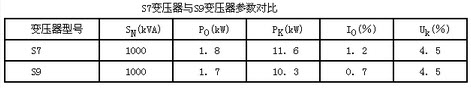
该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾
①电解槽的阳极反应式为______.此时通过阴离子交换膜的离子数______(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数.
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)______导出,制得的氧气从出口(填写“A”、“B”、“C”、“D”)______导出.
③通电开始后,阴极附近溶液pH会增大,请简述原因______.
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为______.
①电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数.
故答案为:4OH--4e-=2H2O+O2↑;<.
②氢氧化钠在阴极生成,所以在D口导出;氧气在阳极生成,且氧气是气体,所以从B口导出.
故答案为:D,B.
③通电开始后,阴极上氢离子放电生成氢气,氢离子来自于水,所以促进水的电离,导致溶液中氢氧根离子的浓度大于氢离子的浓度,所以溶液的PH值增大.
故答案为:H+放电,促进水的电离,OH-浓度增大.
④燃料原电池中,燃料在负极上失电子发生氧化反应,氧化剂在正极上得电子发生还原反应,该燃料原电池中,氧气是氧化剂,所以氧气在正极上得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-.
故答案为:O2+2H2O+4e-=4OH-.