问题
实验题
实验室常用一定质量分数的过氧化氢无色溶液(溶质为H2O2),在二氧化锰作催化剂的条件来制取氧气。某同学实验前测得过氧化氢溶液42.5g ,加入1 g MnO2,完全反应后测得反应容器中剩余物质量为41.9g

请回答:
(1 )实验室用分解双氧水的方法制取氧气时,选择的发生装置应为_________ 。
(2 )收集装置应选择_________ ,原因是____________________________________ 。
(3 )反应后放出氧气的质量是多少,所用过氧化氢溶液中溶质的质量分数是多少?[计算结果保留一位小数,计算过程按步骤写在答卷纸上]
答案
(1 )B ;
(2 )C 或D,氧气不易溶于水且比空气的密度大;
(3 )解:①m 氧气= 42.5g +1g-41.9g=1.6g;
②设过氧化氢溶液中溶质的质量为X ,则
2H2O2 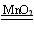 2H2O + O2↑
2H2O + O2↑
68 32
X 1.6g
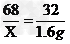
∴ X =3.4g
∴过氧化氢溶液中溶质的质量分数=3.4g/42.5g ×100%=8%
答:过氧化氢溶液中溶质的质量分数为8%
