在标准状况下,将224 L HCl气体溶于645 mL (ρ=1.00 g·cm-3)的水中,所得盐酸的密度为1.20 g·cm-3。试求:
(1)该盐酸的物质的量浓度。
(2)标准状况下,取这种盐酸100 mL,与足量的NaHCO3溶液反应后,放出多少升气体?气体干燥后,通过盛有足量Na2O2固体的容器,充分反应后,容器内固体增重多少克?
(1)12.0 mol· L-1
(2)26.9 L33.6 g
(1)n(HCl)="224" L/22.4 L· mol-1="10.0" mol
m(HCl溶液)="635" g+10.0 mol×36.5 g· mol-1=1.00×103g
c(HCl)=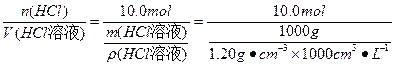 =" 12.0 " mol · L-1
=" 12.0 " mol · L-1
(2)HCl+NaHCO3====NaCl+H2O+CO2↑
1 mol 22.4 L
0.100 L×12.0 mol· L-1="1.20" mol V(CO2)
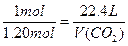
V(CO2)="22.4" L×1.20 mol÷1 mol="26.9" L
2Na2O2+2CO2====2Na2CO3+O2 固体质量增加
44.8 L 56 g
26.9 L Δm
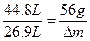 Δm="33.6" g
Δm="33.6" g
该盐酸的物质的量浓度为12.0 mol·L-1;放出的气体的体积为26.9 L;容器内固体增重33.6 g。
