问题
选择题
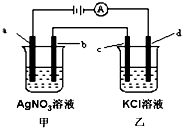
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
A.若向甲烧杯中滴加紫色的石蕊试液,通电一段时间后,溶液会变红
B.乙烧杯中的d电极反应式为Fe-3e-=Fe3+
C.当电解一段时间后,将甲、乙两溶液混合,一定会有沉淀生成
D.当b极增重5.4g时,d极产生的气体为2.24L(标准状况)
答案
A.通电一段时间后,甲中阳极发生4OH--4e-=2H2O+O2↑,阴极发生4Ag++4e-=4Ag,反应后为硝酸,滴加紫色的石蕊试液,溶液会变红,故A正确;
B.乙烧杯中的d电极反应式为2H++2e-=H2↑,故B错误;
C.当电解一段时间后,甲可能为硝酸,乙为KOH,则二者混合不会生成沉淀,故C错误;
D.b极增重5.4g时,n(Ag)=
=0.05mol,由2Ag~2e-~H2↑,则d极产生的气体为0.025mol×22.4L/mol=0.56L,故D错误;5.4g 108g/mol
故选A.
