M、R都是生活中常见的金属单质,其中R是用量最多的金属.甲、乙是化合物,其中甲是黑色晶体,可由R在X中燃烧得到.
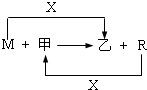
(1)M与甲在高温下反应的化学方程式是______.
(2)电解法制R低价氢氧化物的装置如图.a是4mol•L-1NaCl、1mol•L-1NaOH的混合溶液.
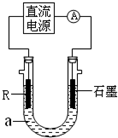
①配制a时需要除去蒸馏水中溶解的O2,常采用______的方法.
②石墨电极应与电源的______(填“正”或“负”)极相连接,通电后,R电极附近的现象是______,R极的电极反应式是______.
③停止实验一段时间后,在R极上部有红褐色物质产生,反应的化学方程式是______.
(3)把R的某氧化物粉末与M粉末混合后分成两等份.一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应.前后两种情况下生成的气体质量比是a:b,则R的氧化物的化学式是______.
(1)根据题意和图示内容,R是用量最多的金属,可知R是金属铁,甲是黑色晶体,可推知甲是四氧化三铁,能将铁的氧化物中的铁置换出来的反应原理是铝热反应原理,
故答案为:8Al+3Fe3O4
4Al2O3+9Fe; 高温 .
(2)①氢氧化亚铁的制取,必须避开空气中的氧气,加热煮沸溶液能将溶液中的气体物质除去,故答案为:煮沸;
②电解法制取氢氧化亚铁时,金属铁必须作阳极,在该电极上,金属铁失电子,所以石墨做阴极,石墨电极应与电源的负极相连,在阳极附近生成的亚铁离子会和氢氧根反应生成氢氧化亚铁白色沉淀,故答案为:负;生成白色沉淀;Fe-2e-+2OH-=Fe(OH)2↓;
③氢氧化亚铁沉淀很容易被空气氧化为氢氧化铁,反应的化学方程式是:4Fe(OH)2 +O2+2H2O═4Fe(OH)3,故答案为:4Fe(OH)2 +O2+2H2O═4Fe(OH)3;
(3)生成的氢气质量比是a:b,也就是物质的量之比为a:b,第一份在高温下恰好完全反应后,再与足量盐酸反应,则Fe+2HCl=FeCl2+H2↑,设产生的氢气物质的量为a,则消耗金属铁的物质的量为a,另一份直接放入足量的烧碱溶液中充分反应,即2Al+6H2O+2NaOH=2Na[Al(OH)4]+3H2↑,产生的氢气物质的量为b,则消耗金属铝的量为
,在铁的氧化物和金属铝的反应中,设反应为:FexOy+Al→Al2O3+Fe,根据原子守恒,金属铁的物质的量为a,则x=a,金属铝的物质的量为2b 3
时,则氧化铝中的氧原子物质的量为b,即y=b,2b 3
故答案为:FeaOb.
