碘被称为“智力元素”,科学合理地补碘可防止碘缺乏症.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.以碘为原料,通过电解可以制备碘酸钾.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却(实验装置如右图所示).以下有关该实验的说法错误的是( )
A.碘是紫黑色固体物质,实验室常用升华法来分离提纯含有少量杂质的固体碘
B.电解时,阳极上发生反应的电极反应式为I-+6OH--6e-=IO3-+3H2O
C.通过离子交换膜的K+离子的运动方向是从右向左
D.当有3mol电子发生转移时,其中被还原生成的KIO3的物质的量为0.5mol
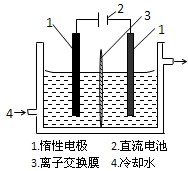
A.碘易升华,加热时碘与杂质分离,实验室常用升华法来分离提纯含有少量杂质的固体碘,故A正确;
B.电解时,阳极上发生氧化反应,碘离子向阳极移动,在阳极上失去电子生成碘酸根离子,电极反应式为I-+6OH--6e-=IO3-+3H2O,故B正确;
C.由电源可知,左端电极与正极相连,则左端为阳极,则K+离子通过离子交换膜移向左端,运动方向是从右向左,故C正确;
D.由3I2+6KOH=5KI+KIO3+3H2O可知,转移5mol电子被还原生成的KIO3的物质的量为1mol,所以当有3mol电子发生转移时,其中被还原生成的KIO3的物质的量为0.6mol,故D错误;
故选D.
