铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.填写下列空白:
(1)配制实验用的溶液.要配制200mL密度为1.2g•cm-3的溶质质量分数为16%的NaOH溶液,需要称取______g NaOH固体.
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗.写出除去氧化膜的离子方程式______.
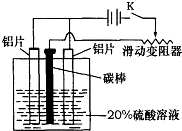
(3)如图,组装好仪器,接通开关K,通电约25min.在阳极生成氧化铝,阴极产生气体.写出该过程中的电极反应式:
阳极______
阴极______
(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净.写出该过程发生反应的离子方程式______.
(1)200mL密度为1.2g•cm-3的溶质质量分数为16%的NaOH溶液,溶液中氢氧化钠质量=200ml×1.2g•cm-3×16%=38.4g;
故答案为:38.4;
(2)铝表面有氧化铝,氧化铝是两性氧化物溶于氢氧化钠溶液中反应生成四羟基合铝酸钠或偏铝酸钠,反应的离子方程式为:Al2O3+2OH-+3H2O=2[A1(OH)4]-或Al2O3+2OH-=2AlO2-+H2O;
故答案为:Al2O3+2OH-+3H2O=2[A1(OH)4]-或Al2O3+2OH-=2AlO2-+H2O
(3)装置图分析铝接电源正极在电解池中 做阳极失电子生成氧化铝,电极反应为:2Al+3H2O→Al2O3+6H++6e-;溶液中氢离子在阴极得到电子生成氢气,电极反应为:6H++6e-→3H2↑;
故答案为:2Al+3H2O→Al2O3+6H++6e- 6H++6e-→3H2↑;
(4)用1%稀氨水中和表面的酸液,是和稀硫酸发生的反应,反应离子方程式为:NH3•H2O+H+=NH4++H2O;
故答案为:NH3•H2O+H+=NH4++H2O;
