钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.V2O5是接触法制硫酸的催化剂.
(1)一定条件下,SO2 与空气反应t min后,SO2 和SO3物质的量浓度分别为a mol/L、b mol/L,则SO2 起始物质的量浓度为______mol/L;生成SO3的化学反应速率为______.
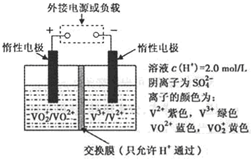
(2)全钒液流储能电池是利用不同价态离子对,发生氧化还原反应来实现化学能和电能相互转化的,其装置原理如图:
①当左槽溶液逐渐由黄变蓝,其电极反应式为______.
②充电过程中,右槽溶液颜色逐渐由______色变为______色.
③充电时若转移的电子数为3.01×1024个,左槽溶液中n(H+)的变化量为______ mol.
(1)2SO2+O2
2SO3催化剂 . △
始:x 0
转:b b
平:a b
x-b=a,x=a+b,故x=a+b,
v(SO3)=
=c t
=b mol/L t min
mol/(L•min)b t
故答案为:a+b;
mol/(L•min);b t
(2)①当左槽溶液逐渐由黄变蓝,其电极反应式为VO2++2H++e-=VO2++H2O,说明此时为原电池,且为原电池的正极.
故答案为:VO2++2H++e-=VO2++H2O;
②充电过程中,右槽连接的是电源负极,为电解池的阴极,电极反应式为V3++e-=V2+,V3+为绿色,V2+为紫色,
故可以看到右槽溶液颜色逐渐由绿色变为紫色.
故答案为:绿;紫;
③充电时,左槽发生的反应为VO2++H2O=VO2++2H++e-,当转移电子为3.01×1024个即为5 mol电子时,生成氢离子为10 mol,此时氢离子参与正极反应,通过交换膜定向移动使电流通过溶液,溶液中离子的定向移动可形成电流,通过5mol电子,则左槽溶液中n(H+)的变化量为10mol-5mol=5mol,
故答案为:5.
