问题
计算题
将25 g硫酸铜晶体溶解于水中,配成1 L溶液,此溶液的物质的量浓度是多少?取其溶液100 mL,向其中加入100 mL 0.2 mol·L-1的NaOH溶液,反应后溶液的物质的量浓度又是多少?(设混合后溶液体积不变)
答案
c(CuSO4)="0.1" mol·L-1;c(Na2SO4)="0.05" mol·L-1。
CuSO4溶液的物质的量浓度是:
c(CuSO4)=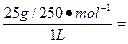 0.1 mol·L-1。
0.1 mol·L-1。
取100 mL 0.1 mol·L-1CuSO4溶液,其中含CuSO4的物质的量:
n(CuSO4)="0.1" mol·L-1×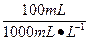 ="0.01" mol
="0.01" mol
100 mL 0.2 mol·L-1NaOH溶液中含NaOH的物质的量:
n(NaOH)="0.2" mol·L-1×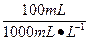 ="0.02" mol
="0.02" mol
CuSO4 + 2NaOH====Na2SO4 +Cu(OH)2↓
1 mol 2 mol 1 mol
0.01 mol 0.02 mol
由方程可知CuSO4与NaOH 恰好反应,生成0.01 mol Na2SO4。
Na2SO4溶液的物质的量浓度:
c(Na2SO4)=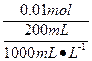 ="0.05" mol·L-1。
="0.05" mol·L-1。