实验室要配制1 L含0.17 mol K2SO4、0.16 mol KCl、0.50 mol NaCl的溶液。现因无K2SO4,只有Na2SO4、KCl、NaCl,如何配制所需溶液?简述操作步骤。
用天平称取37.3 g KCl、24.1 g Na2SO4、9.4 g NaCl 放入一个烧杯中,加入适量蒸馏水,搅拌,使之全部溶解,转移到1 L容量瓶中,用蒸馏水洗涤烧杯两次。把洗涤液都注入容量瓶里,然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1—2 cm处,改用胶头滴管加水到瓶颈刻度处,使溶液的凹面正好跟刻度相平,塞上塞子,摇匀。
依题意,0.17 mol K2SO4和0.16 mol KCl中的K+由KCl提供,根据K+的物质的量守恒,
n(KCl)=n(K+)
="0.17" mol×2+0.16 mol×1
="0.50" mol,
所以m(KCl)="n(KCl)·M(KCl)=0.50" mol×74.5 g·mol-1="37.3" g。
根据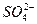 的物质的量守恒,n(Na2SO4)=n(K2SO4)="0.17" mol,故
的物质的量守恒,n(Na2SO4)=n(K2SO4)="0.17" mol,故
m(Na2SO4)=n(Na2SO4)·M(Na2SO4)="0.17" mol×142 g·mol-1="24.1" g。
根据Na+的物质的量守恒,n(NaCl)=0.50 mol-0.17 mol×2="0.16" mol,所以,m(NaCl)="n(NaCl)·M(NaCl)=0.16" mol×58.5 g·mol-1="9.4" g。

