问题
选择题
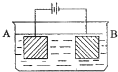
按如图所示的装置进行实验:A极是铜锌合金,B极是纯铜,电解质溶液中含有足量的铜离子,通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn的物质的量之比为( )
A.4:1
B.3:1
C.2:1
D.1:1
答案
B极上析出的是铜,B极质量增加7.68g,其物质的量=
=0.12mol;7.68g 64g/mol
阳极上溶解锌时,阴极上析出铜,所以溶液质量增加的质量为锌和铜的质量差,溶液质量增加0.03g,即锌和铜的质量差为0.03g.
设锌的物质的量为x,则:
Zn+Cu2+═Zn2++Cu 质量增加
1mol 1g
x0.03g
x=0.03mol.
即合金中锌的物质的量是0.03mol.
根据氧化还原反应中得失电子数相等知,阳极上锌和铜失去的电子数等于阴极上铜离子得到的电子,设合金中铜的物质的量为y,则:
0.03mol×2+2y=0.12mol×2
y=0.09mol,
所以合金中铜和锌的物质的量之比为0.09mol:0.03mol=3:1,所以铜和锌的原子个数之比是3:1,
故选:B.
