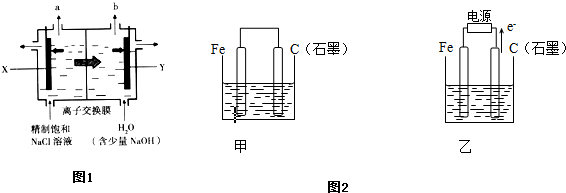
Ⅰ.如图1装置,用离子交换膜法电解饱和食盐水制烧碱.若X电极材料为金属钛网(表面有氧化物涂层),Y电极材料为碳钢网.阳离子交换膜只允许阳离子通过,而阻止阴离子和气体通过.分别收集两极产生的气体并通入淀粉KI溶液中.请回答下列问题:
(1)能使淀粉KI溶液变蓝的是______(填“a”或“b”)气体;
(2)其阳极的电极反应式为______,阴极的电极反应式为______;
Ⅱ.如图2所示,甲、乙是两个电化学实验装置.
(1)若甲、乙两烧杯中均盛有CuSO4溶液.
①甲中铁棒上的电极反应式为______;
②电解一段时间后,若要使乙装置中溶液恢复到电解前的状态,可向溶液中加入______;(填写物质的化学式).
(2)起初,若乙装置中盛有含0.5mol NaCl和0.1mol CuSO4的混合溶液.电解一段时间后,当有0.4mole-发生转移时,阴极产生气体______mol.
Ⅰ.由阳离子移动方向可知Y为阴极,X为阳极,则a为Cl2,为电解池阳极产物,b为H2,为电解池阴极产物,
(1)能使淀粉KI溶液变蓝的为氯气,在a极上生成,故答案为:a;
(2)阳极的电极反应式为2Cl--2e-=Cl2↑,阴极的电极反应式为2H++2e=H2↑(或2H2O+2e=H2↑+2OH-),
故答案为:2Cl--2e-=Cl2↑;2H++2e=H2↑(或2H2O+2e=H2↑+2OH-);
Ⅱ.(1)若甲、乙两烧杯中均盛有CuSO4溶液,甲为原电池,乙为电解池,由电子转移的方向可知C棒为阳极,铁棒为阴极,
①甲中铁棒为原电池的负极,电极反应式为Fe-2e-═Fe2+,故答案为:Fe-2e-═Fe2+;
②乙为电解硫酸铜溶液,阳极生成氧气,阴极析出铜,则应加入CuO,溶液可恢复到电解前的状态,
故答案为:CuO;
(2)阴极分别发生:Cu2++2e-=Cu,、2H++2e=H2↑,
当有0.4mole-发生转移时,阴极首先析出0.1mol铜,需0.2mol电子,进而生成0.1mol氢气,
故答案为:0.1.

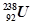 )衰变为铅核(
)衰变为铅核(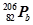 )的过程中,要经过8次α衰变和10次β衰变
)的过程中,要经过8次α衰变和10次β衰变