问题
选择题
实验室可用下列方法制取氯气:
MnO2+4HCl MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
KClO3+6HCl KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
NaClO+2HCl NaCl+Cl2↑+H2O
NaCl+Cl2↑+H2O
Ca(ClO)2+4HCl CaCl2+2Cl2↑+2H2O
CaCl2+2Cl2↑+2H2O
若制取Cl2的质量相同,则转移电子的物质的量之比为()
A.1∶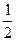 ∶1∶
∶1∶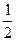 ∶1
∶1
B.2∶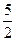 ∶3∶1∶
∶3∶1∶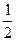
C.1∶1∶1∶1∶1
D.2∶2∶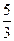 ∶1∶1
∶1∶1
答案
答案:D
本题可从反应转移电子数入手分析:

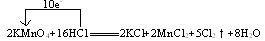
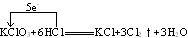
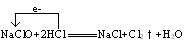

氯气的制取原理是用氧化剂氧化Cl-而得到氯气,若使用KClO3,则转移5 mol e-,可得Cl2 3 mol。制取1 mol Cl2转移电子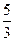 mol。若用Ca(ClO)2,每生成1 mol Cl2转移1 mol e-,也就是1 mol Cl-被氧化,1 mol
mol。若用Ca(ClO)2,每生成1 mol Cl2转移1 mol e-,也就是1 mol Cl-被氧化,1 mol 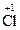 被还原,两者结合为1 mol Cl2。因为在反应生成的Cl2中,包括被氧化的氯和由高价被还原为0价的氯,所以生成氯气的物质的量和转移电子的物质的量之比与前一种情况不同,且随反应物的不同,其比值也不同。
被还原,两者结合为1 mol Cl2。因为在反应生成的Cl2中,包括被氧化的氯和由高价被还原为0价的氯,所以生成氯气的物质的量和转移电子的物质的量之比与前一种情况不同,且随反应物的不同,其比值也不同。
根据电子转移数和化学方程式计算,上述五种氧化剂在制取1 mol Cl2时,转移电子的物质的量之比为2∶2∶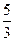 ∶1∶1。
∶1∶1。
