如图所示装置,通电5min后,第③极增重2.16g,同时在A池中收集到224mL气体(标准状况下).
请回答下列问题:
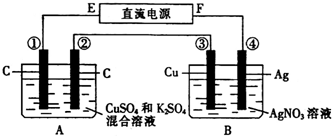
(1)E为______极;
(2)第②极上产生的气体是______,物质的量为______;
(3)写出第①极上发生反应的电极反应式:______;
(4)设A池中原混合液的体积为200mL,则通电前A池中原混合液中Cu2+的物质的量浓度为______.
(1)通电5min后,第③极增重,所以第③极是阴极,则F是电源正极,E为电源负极;
故答案为:负;
(2)第②极是阳极,A中阳极上氢氧根离子放电生成氧气,其电极反应式为:4OH--4e-=2H2O+O2↑,
第③极反应为Ag++e-=Ag,n(Ag)=
=0.02mol,则转移的电子为0.02mol,2.16g 108g/mol
A池中阳极反应为4OH--4e-=2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol;
故答案为:O2,0.005mol;
(3)A池中阳极反应为4OH--4e-=2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL<224mL,所以在阴极上含有气体生成,在阴极也生成112mL气体,由2H++2e-=H2↑,则氢气的物质的量为0.005mol,其体积是0.005mol×22.4L/mol=0.112L=112mL,阴极电极应为:Cu2++2e-=Cu 2H++2e-=H2↑;
故答案为:Cu2++2e-=Cu 2H++2e-=H2↑;
(4)由(3)分析计算可知溶液中铜离子全部放电,Cu2++2e-=Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=
=0.025 mol•L-1,故答案为:0.025 mol•L-1.0.005mol 0.2L
