问题
计算题
向密度为1.45 g·cm-3的硫酸溶液中,逐滴加入氯化钡溶液直至沉淀完全。过滤后所得溶液质量与加入的氯化钡溶液质量相等。则原硫酸溶液的物质的量浓度是多少?
答案
设硫酸溶液中有1 mol H2SO4。
H2SO4+BaCl2====BaSO4↓+2HCl
1 mol 233 g
c(H2SO4)=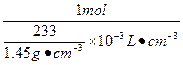
="6.22" mol·L-1
答:原硫酸溶液的物质的量浓度是6.22 mol·L-1
硫酸与氯化钡反应生成硫酸钡沉淀和盐酸,滤去沉淀后溶液的质量等于氯化钡溶液的质量,也就是沉淀的质量等于硫酸溶液的质量,按产生沉淀的质量去计算参加反应的硫酸的物质的量,即可得出结果。
